



小鼠白细胞介素10(IL-10)ELISA检测试剂盒
1、试剂盒简介
本试剂盒采用“双抗体夹心法”:将小鼠白细胞介素10(IL-10)捕获抗体包被于酶标板上,捕获样品及标准品中的靶标,加入生物素标记的抗体与靶标结合,然后再加入酶结合物与生物素标记抗体结合,形成免疫复合物,加入TMB显色液后,若反应孔中有靶标则显蓝色,加入终止液变黄色,检测过程中游离的成分均被洗去,用酶标仪在450 nm处测OD值,颜色的深浅和样品中的小鼠白细胞介素10(IL-10)呈正比,通过绘制标准曲线计算出标本中IL-10的浓度。本试剂盒检测范围为3.75-240pg/mL,检测灵敏度为1.98 pg/mL。可检测样品中的小鼠IL-10,且与其它类似物无明显交叉反应,板内,板间变异系数均<10% 。
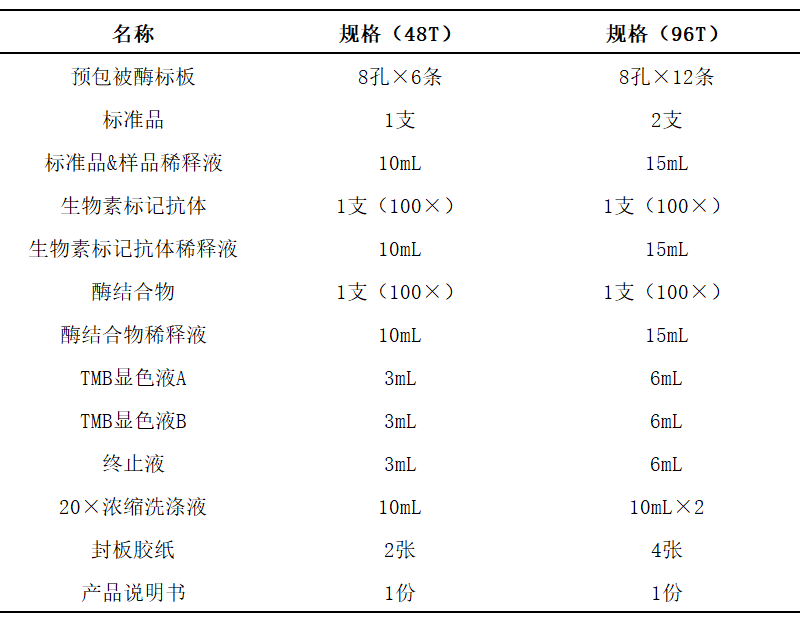
2、试剂盒组分

3、保存
本试剂盒应于 2-8℃保存,有效期 6 个月
4、实验所需自备试验器材
4.1 酶标仪(可测量450nm检测波长的吸收值)
4.2 高精度加液器及一次性吸头
4.3 蒸馏水或去离子水
4.4 37℃恒温箱
4.5 多通道洗板器或自动洗板机
5、样品稀释方案
由于样品存在个体差异,请提前预估样品的浓度范围,并通过预实验确定待检样品的稀释倍数。如果您的样品需要稀释,通用稀释方案参考如下:
稀释 100 倍:一步稀释。取5μL样品到495μL标准品&样品稀释液内,做100倍稀释;
稀释 1000 倍:两步稀释。取5μL样品到95μL标准品&样品稀释液内,做20倍稀释,再取5μL 20倍稀释样品到245μL标准品&样品稀释液内,做50倍稀释,总共稀释1000倍;
每步稀释时取液量不少于3μL,稀释倍数不超过100倍。每步稀释都需混合均匀,避免起泡。
6、样品处理及保存
样品收集后若在1周内进行检测可保存于2-8℃,若不能及时检测,请按一次使用量分装,冻存于-20℃(1个月内检测),或-80℃(3个月内检测),避免反复冻融。在检测前,冷冻过的样品应缓慢地融化并离心除去冻融过程产生的沉淀物。室温混匀后使用。
6.1 血清:使用血清分离管收集样品,样品在室温下放置30分钟,然后以1000×g离心15分钟。立即取出血清并进行检测,或将样品分装并保存在-20℃以下,避免反复冻融。
6.2 血浆:使用EDTA或肝素作为抗凝血剂收集血浆。在收集后的30分钟内,以2-8℃ 1000×g 离心15分钟。立即取出血浆并进行检测,或将样品分装并保存在-20℃以下,避免反复冻融。
6.3 组织匀浆:用预冷的PBS(0.01M, pH=7.4)冲洗以去除残留血液。称重后剪碎组织,按1:9(w/v)比例加入PBS(推荐提前加入蛋白酶抑制剂),放入玻璃匀浆器中冰上研磨。为提高裂解效率,可超声破碎或反复冻融。最后,将匀浆液于5000×g离心5-10分钟,立即取出上清并进行检测,或将样品分装并保存在-20℃以下,避免反复冻融。
6.4 细胞培养物上清:1000×g离心20分钟以去除颗粒,立即取出上清并进行检测,或将样品分装并保存在-20℃以下,避免反复冻融。
6.5 细胞裂解液:贴壁细胞经预冷PBS清洗后,胰蛋白酶消化并1000×g离心5分钟收集;悬浮细胞直接离心收集。收集的细胞用预冷PBS清洗3次,每1×10^6个细胞加150-200μL PBS(推荐提前加入蛋白酶抑制剂)重悬,反复冻融或超声细胞破碎。最后,2-8℃ 1500×g离心10分钟,取上清检测。
6.6 其它生物样品:1000×g离心20分钟,取上清即可检测。
7、检测前试剂准备
7.1 提前20分钟从冰箱中取出试剂盒,平衡至室温。如果试剂盒需分多次使用,请仅取出本次实验所需的酶标板条和试剂,剩余板条和试剂需按照指定条件保存。读数前15分钟打开酶标仪预热。
7.2 洗涤液配制:用蒸馏水1:20稀释(例:1mL浓缩洗涤液加入19mL的蒸馏水)。从冰箱中取出的浓缩洗涤液可能有结晶,属于正常现象,可用40℃水浴,稍微加热使结晶完全溶解后再配制洗涤液。当日使用。
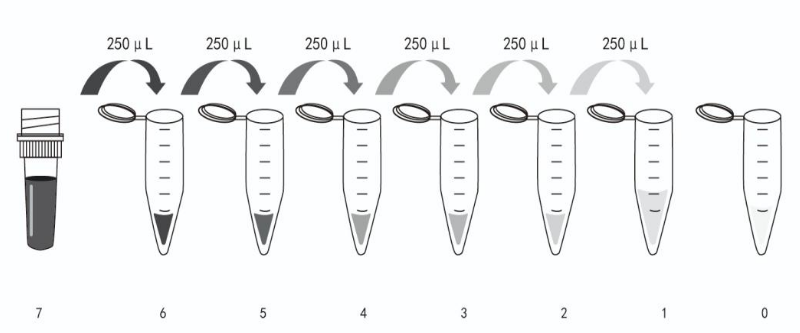
7.3 标准品配制:试剂盒中取出标准品,加入1mL标准品&样品稀释液溶解,盖好后室温静置大约10分钟。取7个1.5mL离心管,分别标注S6,S5,S4,S3,S2,S1,S0后每管各加入250μL标准品&样品稀释液。从S7中吸取250μL标准品到第一个离心管S6中,轻轻吹打混匀。从S6中吸取250μL到第二个EP管中(S5),轻轻吹打混匀。依次倍比稀释浓度为240 pg/mL,120 pg/mL,60 pg/mL,30 pg/mL,15 pg/mL,7.5 pg/mL,3.75 pg/mL。以此类推进行标准品的倍比稀释。S0为标准品&样品稀释液(0 pg/mL)。

7.4 生物素标记抗体工作液配制:使用前20分钟,以生物素标记抗体稀释液将100×浓缩生物素标记抗体稀释成1×工作浓度(例如:10μL浓缩液+990μL稀释液)。根据所需用量配制,当日使用,剩余弃之。
7.5 酶结合物工作液配制:使用前20分钟,以酶结合物稀释液将100×浓缩酶结合物稀释成1×工作浓度(例如:10μL浓缩液+990μL稀释液)。根据所需用量配制,当日使用,剩余弃之。
7.6 TMB显色液的配制:使用前10分钟,将TMB显色液A液和B液1:1混合,避光放置备用。
8、操作步骤:
8.1 加样:分别将样品或不同浓度标准品按照100μL每孔加入相应孔中,空白孔加入100μL标准品&样品稀释液。盖上封板膜后37℃温育60分钟。(建议:将待测样品用标准品&样品稀释液最低稀释1倍后再加入酶标板内测试。从而减少基质效应对测试结果的影响,最后计算样品浓度时需乘以对应的稀释倍数。)
8.2 弃液:弃去液体,甩干,不用洗涤。
8.3 加生物素标记抗体:每孔加入100μL生物素标记抗体工作液,混匀后置37℃温育60分钟。
8.4 洗板:用1×洗涤液将反应板充分洗涤4-6次,每孔加入350μL1×洗涤液,每次震荡/浸泡1-2分钟,在滤纸上拍干。
8.5 加酶结合物:每孔加入100μL酶结合物工作液,混匀后置37℃温育30分钟。
8.6 洗板:同步骤4。
8.7 加显色液:每孔加入提前配制好的100μL TMB混合液,混匀后置37℃暗处反应10-20分钟(具体显色时间根据显色结果而定)。
8.8 加终止液:每孔加入50μL终止液,混匀,终止反应。(提示:终止液的加入顺序应尽量与底物溶液的加入顺序相同。)立即用酶标仪在450nm波长测量各孔的光密度(OD值)。
9、结果计算:
9.1 计算标准品和样品复孔的平均OD值,使用计算机软件以浓度为横坐标、OD值为纵坐标,在双对数坐标轴上作四参数逻辑曲线拟合创建标准曲线。
9.2 若样品OD值高于标准曲线上限,应适当稀释后重新测试,并在计算样品浓度时乘以相应的稀释倍数,即为样品的实际浓度。

10、注意事项:
10.1 本产品仅供科学研究使用,不能用于临床诊断,如果用于临床诊断或任何其他用途,我们将不对任何后果负责。
10.2 实验过程中请穿戴实验服、口罩和乳胶手套。请按照生物实验室的国家安全规定进行实验,尤其是在检测血样或其他体液时。
10.3 为了实验结果的准确性,请仅使用我们提供的试剂,并且不要混用不同批次的试剂。
10.4 不同厂家的试剂盒或通过其他方法检测相同的指标结果可能有差异。
10.5 若所检样品不在说明书所列样品之中,建议做预实验验证其检测有效性。
10.6 若使用化学裂解液制备组织匀浆或细胞提取液,由于引入某些化学物质会导致ELISA测值出现偏差。
10.7 某些重组蛋白可能与试剂盒中捕获或检测抗体不匹配而出现不能检测的情况。
10.8 为了获得可重复的结果,应严格控制实验中的每个步骤,样品收集、处理和存储的变化也可能导致样品测量的差异。
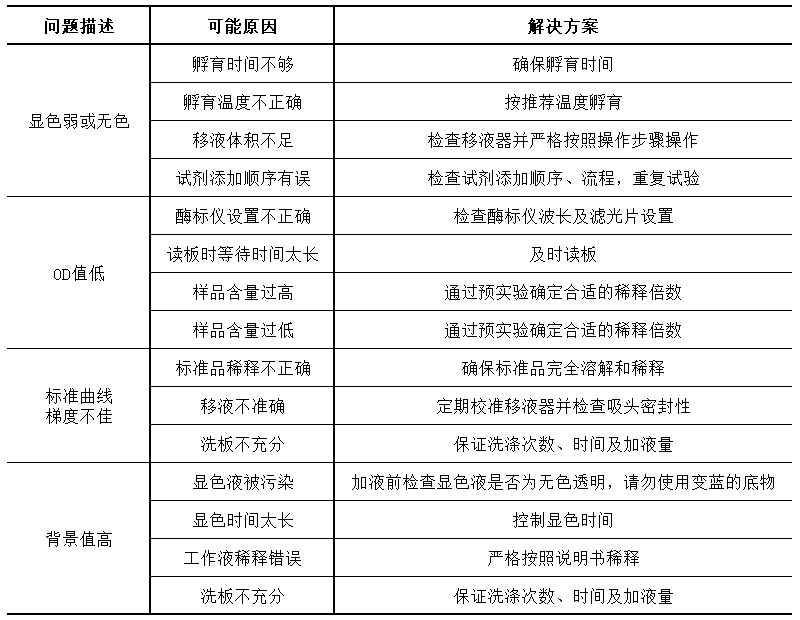
11、问题分析
-
小鼠γ干扰素诱导单核因子(MIG;CXCL9)ELISA检测试剂盒
- Catalog: TD-BK04294
- Size: 96T
- Reactivity: Mouse
- Sample: 细胞,血液,组织,病毒
